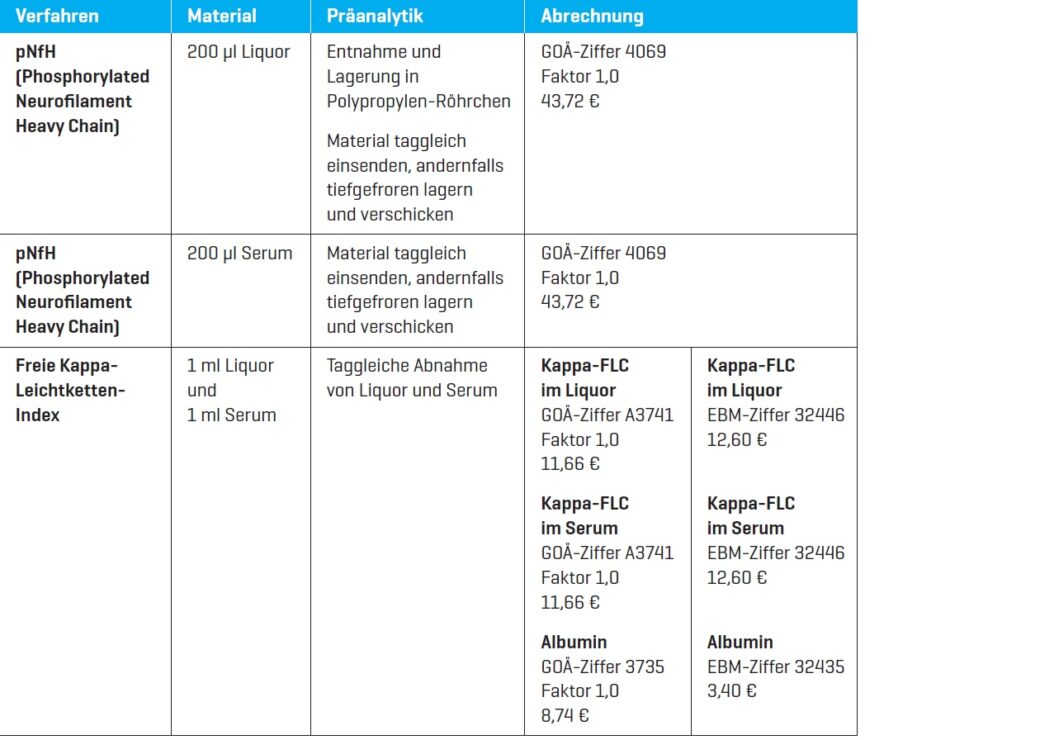
Sehr geehrte Kolleginnen und Kollegen,
gemeinsam mit Dr. Dieter Münstermann übernehme ich zum 1. Januar 2024 Leitungsverantwortung
im Labor Krone. Ich bin mit den aktuellen Herausforderungen der Labormedizin vertraut und freue
mich, nach dem Ausscheiden von Prof. Bertin Dufaux, das Team Krone zu ergänzen. Neben den
Bereichen Labormedizin, Mikrobiologie und Hygiene wird das Labor auch in den Bereichen Humangenetik
(Dr. Carmela Beger) und Endokrinologie (Dr. Michael Dölle) ärztlich vertreten. Auch die modernen
Strukturen in den Bereichen EDV, Logistik und Dienstleistung mit ihren engagierten Mitarbeitenden
in einem unabhängigen Labor haben zu meiner Entscheidung beigetragen.
Sehr gerne würde ich Sie persönlich kennenlernen und wäre dankbar, wenn Sie mir im neuen Jahr
Gelegenheit dazu geben. Meinen beruflichen Werdegang habe ich hier kurz skizziert:
Nach meinem Studium der Wirtschaftswissenschaften an der University of Scotland in St. Andrews
und einem kurzen Ausflug in die Unternehmensberatungen Targus und der Boston Consulting Group,
habe ich mein Medizinstudium an der Johannes-Gutenberg-Universität Mainz angeschlossen. Die
Weiterbildung zum Facharzt für Laboratoriumsmedizin absolvierte ich zunächst an der Technischen
Universität München. Als Stipendiat der Else-Kröner-Fresenius-Stiftung habe ich wissenschaftlich
am TranslaTUM in der Grundlagenforschung zur Tumorgenese gearbeitet. Die klinische Zeit führte
mich an das Universitätsspital Zürich mit den Schwerpunkten Hämatoonkologie und Immunologie.
2021 zog es mich in meine Heimat Westfalen zurück. Seither bin ich ein Mitglied im Team Labor Krone
und schätze die dynamische und konstruktive Zusammenarbeit. Ich möchte meine persönliche
Expertise zur innovativen Weiterentwicklung einbringen, damit wir gemeinsam die zukünftigen
Herausforderungen meistern.
Ich freue mich sehr auf unsere künftige Zusammenarbeit und stehe Ihnen für Anregungen und Fragen
jederzeit zur Verfügung.
Ihr Erik Hameister und das Team des Labor Krone
Dr. med. Erik Hameister
Ausbildung, akademischer Werdegang
November 2012 – Dezember 2016
Promotion bei Herrn Prof. Pietrzik Thema: “Charakterisierung eines monoklonalen anti-LRP1 Antikörpers zur Aβ -Transportinhibition”
Universitätsmedizin Mainz der Johannes-Gutenberg-Universität
Oktober 2010 – November 2016
Universitätsmedizin Mainz der Johannes-Gutenberg-Universität
Staatsexamen Humanmedizin
September 2006 – Juni 2010
BSc in Economics & Psychology
(Upper Second Class)
School of Economics and Finance
University of St Andrews, Scotland
Berufliche Erfahrung
Medizin
ab August 2021
MVZ Labor Krone GbR, Bad Salzuflen
Dr. med. Dr. rer. nat. Dieter Münstermann
Facharzt für Laboratoriumsmedizin (seit 15.11.2022)
Januar 2020 – Juni 2021
Universitätsspital Zürich, Schweiz
Klinik für medizinische Onkologie und Hämatologie
Prof. Dr. Markus G. Manz
Assistenzarzt der Hämatologie / Innere Medizin
Januar 2017 – Dezember 2019
Klinikum Rechts der Isar
Institut für Klinische Chemie und Pathobiochemie
Prof. Dr. Jürgen Ruland
Assistenzarzt der Laboratoriumsmedizin
Wirtschaft
Juli 2010 – September 2010
The Boston Consulting Group, Germany
Visiting Associate, Machbarkeitsstudie für ein HR Shared-Service Center bei einem Händler
Juni 2009 – August 2009
Fresenius Kabi Vial, France
Working student, Finance & Controlling Abteilung
Unterstützung des Budgetprozesses (Einsparprojekt)
Juni 2008 – August 2008
Targus Management Consulting AG, Germany
Working student, Project management support
SAP Implementation in der Health Care Industrie
Stipendien, Drittmittel
Juni 2018 – Dezember 2019
Stipendiat im Rahmen des Else Kröner-Forschungskolleg des Klinikum rechts der Isar gefördert durch die Else Kröner-Fresenius-Stiftung
Januar 2018 – April 2018
Fakultätsinterne Förderung – KKF „Einstiegsprogramm“ des Klinikums rechts der Isar
Juni 2014 – Oktober 2014
Reisestipendium für ein Research fellowship an der McGill University durch das Forschungszentrum Translationale Neurowissenschaften Mainz
September 2013 – Oktober 2015
Studies Excellence Stipendium der Manfred Lautenschläger Stiftung im Rahmen des Medical Excellence Programmes
Publikationen
Tim Wartewig, Jay Daniels, Miriam Schulz, Erik Hameister, Abhinav Joshi, Joonhee Park, Emma Morrish, Anuroop V. Venkatasubramani, Filippo M. Cernilogar, Frits H.A. van Heijster, Christian Hundshammer, Heike Schneider, Filippos Konstantinidis, Judith V. Gabler, Christine Klement, Henry Kurniawan, Calvin Law, Yujin Lee, Sara Choi, Joan GuitartIgnasi Forne, Jérôme Giustinani, Markus Müschen, Salvia Jain, David M. Weinstock, Roland Rad, Nicolas Ortonne, Franz Schilling, Gunnar Schotta, Axel Imhof, Dirk Brenner, Jaehyuk Choi*, Jürgen Ruland. PD-1 instructs a tumor-suppressive metabolic program that restricts glycolysis and restrains AP-1 activity in T cell lymphoma. Nat Cancer 4, 1508–1525 (2023).
Sipol A*, Hameister E*, Xue B, Hofstetter J, Barenboim M, Öllinger R, Jain G, Prexler C, Rubio RA, Baldauf MC, Franchina DG, Petry A, Schmäh J, Thiel U, Görlach A, Cario G, Brenner D, Richter GHS, Grünewald TGP, Rad R, Wolf E, Ruland J, Sorensen PH, Burdach SEG. MondoA drives malignancy in B-ALL through enhanced adaptation to metabolic stress. Blood Feb 2022; 139(8):1184-1197.
Landspersky T, Saçma M, Rivière J, Hecker JS, Hettler F, Hameister E, Brandstetter K, Istvánffy R, Marquez SR, Ludwig R, Götz M, Buck M, Wolf M, Schiemann M, Ruland J, Strunk D, Shimamura A, Myers K, Yamaguchi T, Kieslinger M, Leonhardt H, Bassermann F, Götze KS, Geiger H, Schreck C, Oostendorp RAJ. Autophagy in mesenchymal progenitors protects mice against bone marrow failure after severe intermittent stress. Blood. 2022 Feb 3;139(5):690-703.
Hecker JS*, Wahida A*, Hameister E*, Filo A, Ruland J, Bassermann F, Hildebrandt M, Verbeek M, Poeck H. ABO subgroup incompatibility with severe hemolysis after consecutive allogeneic stem cell transplantations. EJHaem. 2021 Mar 24;2(2):280-284.
Kurgyis Z , Vornholz L, Pechloff K, Kemény LV, Wartewig T, Muschaweckh A, Joshi A, Kranen K, Hartjes L, Möckel S, Steiger K, Hameister E, Volz T, Mellett M, French LE, Biedermann T, Korn T, Ruland J. Keratinocyte-intrinsic BCL10/MALT1 activity initiates and amplifies psoriasiform skin inflammation. Sci Immunol. 2021 Nov 26;6(65):eabi4425.
Hameister E, Stolz SM, Fuhrer Y, Thienemann F, Schaer DJ, Nemeth J, Schuepbach RA, Goede J, Reinhart S, Schmidt A, Kahraman A, Schmid M, Moch H, Zoche M, Manz MG, Balabanov S, Boettcher S. Clonal Hematopoiesis in Hospitalized Elderly Patients With COVID-19. HemaSphere August 2020 – Volume 4 – Issue 4 – p e453.
Wartewig T, Kurgyis Z, Keppler S, Pechloff K, Hameister E, Öllinger R, Maresch R, Buch T, Steiger K, Winter C, Rad R, Ruland J. PD-1 is a haploinsufficient suppressor of T cell lymphomagenesis. Nature. 2017 Dec 7;552(7683):121-125.
Rübenthaler J, Paprottka KJ, Hameister E, Hoffmann K, Joiko N, Reiser M, Clevert DA. Malignancies after liver transplantation: Value of contrast-enhanced ultrasound (CEUS). Clin Hemorheol Microcirc. 2016;64(3):467-473. doi: 10.3233/CH-168117. PMID: 27935549
Rübenthaler J, Paprottka KJ, Hameister E, Hoffmann K, Joiko N, Reiser M, Clevert DA. Vascular complications in liver transplantation: Beneficial role of contrast-enhanced ultrasound (CEUS) in the postoperative phase. Clin Hemorheol Microcirc. 2016;64(3):475-482. doi: 10.3233/CH-168118. PMID: 27935550
Meister S., Storck S.E., Hameister E., Behl C., Weggen S., Clement A.M., Pietrzik C. Expression of the ALS-causing variant hSOD1(G93A) leads to an impaired integrity and altered regulation of claudin-5 expression in an in vitro blood-spinal cord barrier model. J Cereb Blood Flow Metab. 2015 Jul;35(7):1112-21.